Baterije - e-učna enota
Kaj je skupnega napravam na sliki?
Odgovor
Naprave na sliki potrebujejo za svoje delovanje baterije.
Zamislite si, kakšno bi bilo vaše življenje, če bi morali biti ob uporabi naprav, ki za svoje delovanje potrebujejo električni tok, vedno nekam priklopljeni s polnilnim kablom?
Baterije nekoč in danes
|
|
Baterije so se od odkritja do danes na videz zelo spremile, vendar temeljni principi delovanja ostajajo enaki.
Oglejmo si, kako so se baterije spreminjale od izuma do danes.
Bagdadska baterija
|
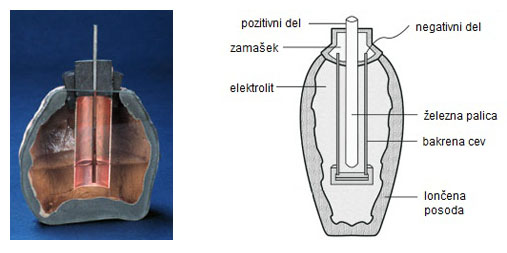
Leta 1936 so v bližini Bagdada izkopali okoli 20 cm visok glinen vrč, star približno 2000 let, iz obdobja Partskega cesarstva.
V glineni vrč je bila vstavljena bakrena cev z železno palico v sredini. Če vanj nalijemo kis, deluje kot galvanski člen z napetostjo od 1 do 2 volta. Vrč so poimenovali bagdadska baterija.
Ker uporabe elektrike v starodavnih časih ne moremo dokazati, je najverjetnejša razlaga, da so bagdadsko baterijo uporabljali za galvansko srebrenje oz. zlatenje nakita.
Luigi Galvani (1737-1798)

|
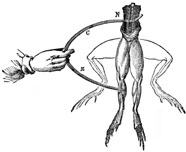
Odkritje galvanskega člena, osnovne enote baterije, je povezano z medicinskimi eksperimenti in ne kemijskimi.
Okoli leta 1780 je Luigi Galvani pri eksperimentiranju z žabjimi kraki opazil njihove premike, če se je dotaknil izpostavljenega živca na dveh mestih, z dvema različnima kovinama.
Zgodovinski viri namigujejo, da je pojav prvič opazil, ko mu je žena postregla žabje krake na pocinkanem krožniku.
Galvani je menil, da elektrika pride iz žabjega kraka in pojav poimenoval živalska elektrika.
Galvanijeve eksperimente je preizkusil tudi Volta in ugotovil, da pojavi niso vezani na živali.
Žabji kraki se skrčijo zaradi dveh različnih kovin in elektrolita med njima.
|
Alessandro Volta (1745-1827)

|
Leta 1800 je Alessandro Volta sestavil prvi preprosti galvanski člen iz ploščic cinka in srebra. Mednje je položil klobučevino, pomočeno v slanico.
Če povežemo več členov skupaj, dobimo Voltov steber, prvo baterijo.
Kasneje je preizkušal različne kombinacije in ugotovil, da dobi najboljše rezultate z bakrom in cinkom, kot elektrolit pa je uporabil razredčeno žveplovo kislino.
Volta je s svojim stolpom dokazal, da je mogoče elektriko generirati s pomočjo kemijskih reakcij.

|
John Frederic Daniell (1790-1845)

|
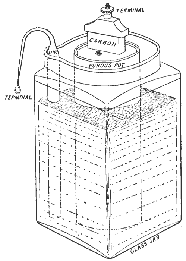
Daniell je nadgradil Voltov stolp z uporabo dveh različnih elektrolitov, bakrovega sulfata in žveplove kisline, ki ju je ločil z lončeno posodo.
Porozna lončena posoda je omogočala izmenjavo ionov, ne da bi se elektrolita mešala.
Elektrodi sta bili bakrena posoda in cinkova plošča.
Daniellov člen je bil veliko bolj varen, zato so ga uporabljali v telegrafskih postajah.

|
Gaston Planté (1834-1889)

|
Leta 1859 je francoski fizik Gaston Planté izumil prvo baterijo s svinčevima elektrodama, ki jo je bilo mogoče zopet napolniti s priključitvijo na zunanji vir napetosti.
Najprej jo je priključil na baterijo drugih galvanskih členov, kmalu pa so za polnjenje začeli uporabljati dinamostroj.
Svinčev akumulator se v skoraj nespremenjeni obliki uporablja v avtomobilih še danes.

|

|
Georges Leclanché (1839-1882)

|
Georges Leclanché je s kombinacijo ogljika in manganovega dioksida za katodo, cinka za anodo ter raztopino amonijevega klorida kot elektrolita, leta 1866 postavil nov mejnik v razvoju baterij.
Leclanchéjev ali “mokri” člen je predhodnik kasneje množično uporabljane cink-ogljikove baterije.
Znanstveniki so se posvetili razvoju “suhih” členov, saj zaradi tekočega elektrolita baterije niso mogli namestiti v poljuben položaj. Prvi prototipi so vsebovali vpojne materiale - celulozo, žagovino ali azbestna vlakna in tako elektrolitu preprečevali razlitje.
|
Carl Gassner (1839-1882)

|
Carl Gassner je leta 1886 pripravil “suhi” člen, kot izboljšan Leclanchéjev člen.
Iz amonijevega klorida in mavca je pripravil gosto pasto ter jo s katodo iz manganovega dioksida in grafitno palčko zaprl v cinkov lonček, ki je bil hkrati tudi anoda.
Takšno baterijo imenujemo suhi člen zato, ker elektrolit ni v tekoči obliki. Baterijo lahko obračamo brez skrbi, da bi se polili z jedko vsebino.
Gassnerjev tip “suhega” člena cink-ogljikove baterije, ki ga najpogosteje imenujemo kar Leclanchéjev suhi člen, je ostal konstrukcijsko nespremenjen in je služil kot podlaga za alkalne baterije, ki jih uporabljamo še danes.
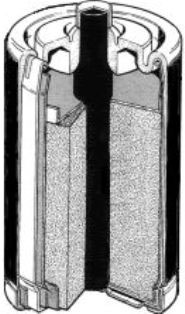
|
Waldemar Junger (1869-1924)
|
Leta 1899 je švedski znanstvenik Waldemar Junger izumil nikelj-kadmijevo baterijo, z nikljem kot katodo, kadmijem kot anodo ter kalijevim hidroksidom kot elektrolitom.
Lahko so jo ponovno napolnili, imela je večjo energijsko gostoto kot svinčeva, vendar je bila dražja.
Nikelj-kadmijeva baterija je bila prva baterija z alkalnim elektrolitom.
Izdelavo priljubljenih in vzdržljivih NiCd baterij so v devetdesetih letih prejšnjega stoletja v Evropi prepovedali zaradi toksičnosti kadmija.

|
Thomas Alva Edison (1847-1931)

|
Edison je želel z lažjo in bolj zanesljivo baterijo od svinčeve prodreti na trg avtomobilov, ki so bili takrat pretežno električni.
Leta 1903 je patentiral nikelj-železovo baterijo z anodo iz železa, katodo iz niklja in kalijevega hidroksida kot elektrolita.
Zaradi slabega delovanja je moral baterijo začasno umakniti iz trga. V sedmih letih, kolikor je Edison potreboval za izboljšavo baterije, ga je prehitel Ford z bolj zanesljivim bencinskim modelom T in avtomobilska industrija se je obrnila v smer bencinskih motorjev.

|

|
Lewis Frederick Urry (1927-2004)

|
Urry je leta 1949 izdelal majhno baterijo iz manganovega dioksida kot katodo in cinka v prahu kot anodo v alkalnem mediju.
Uporaba cinka v prahu je povečala aktivno površino anode in podaljšala čas delovanja baterije.
Te alkalne baterije so po letu 1959 doživele velik komercialni uspeh, saj so bile majhne in so imele dolgo življenjsko dobo.

| 
|
Vojna zajčkov, ali katera baterija zdrži dlje časa.

|
Stanford Robert Ovshinsky (1922-2012)

|
Ovshinsky je leta 1990 izdelal nikelj-metal hidridno baterijo, ki je zamenjala toksične nikelj-kadmijeve baterije. Kadmij na anodi je nadomestil z vodikom v obliki trdnega hidrida, katoda je nikelj, elektrolit pa kalijev hidroksid.
NiMH baterije so manjše, cenejše in okolju prijaznejše, saj jih lahko ponovno polnimo in recikliramo.
V devetdesetih letih prejšnjega stoletja so pripomogle k naglemu razvoju mobilne telefonije in prenosnih električnih naprav.

NiMH baterije so pogosta izbira napajanja v hibridnih vozilih.

|
Razvoj litijevih baterij

|

|
Prve eksperimente z litijem je izvedel že Gilbert Newton Lewis leta 1912, vendar so bile baterije z litijem zaradi njegove reaktivnosti zelo nevarne.
Primarne litijeve baterije so za širšo uporabo razvili v sedemdesetih letih prejšnjega stoletja. Najprej za potrebe vojske, kasneje pa so zaradi vzdržljivosti in dolge življenjske dobe prešle v vsakdanjo rabo.
Danes jih veliko uporabljamo v obliki gumbnih baterij v medicinskih napravah, urah, alarmnih napravah, avtomobilskih ključih.
Leta 1991 je Sony na trg poslal prvo litij-ionsko baterijo, ki jo je bilo mogoče polniti, z grafitno anodo in katodo iz litijevega kobaltata LiCoO2.
Razvoj litij-ionskih baterij se je nadaljeval z iskanjem primernejših katod in elektrolita, v smer:
- litij-ionskih polimernih Li-Poly baterij,
- litij železo fosfatnih,
- nanotehnologije.

|

|

Poglejmo si baterije še od blizu: kako so sestavljene, kakšne kemijske reakcije potekajo v njih, v kakšnih oblikah jih lahko kupimo, kako pravilno ravnamo z njimi in kakšna je njihova prihodnost.
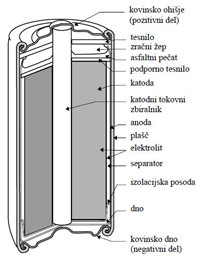
Galvanski člen
Galvanski člen je naprava, ki pretvarja kemijsko energijo snovi neposredno v električno energijo s pomočjo kemijskih reakcij oksidacije in redukcije.
Z galvanskim členom pridobivamo enosmerni električni tok, ki ga lahko uporabimo za opravljanje dela.
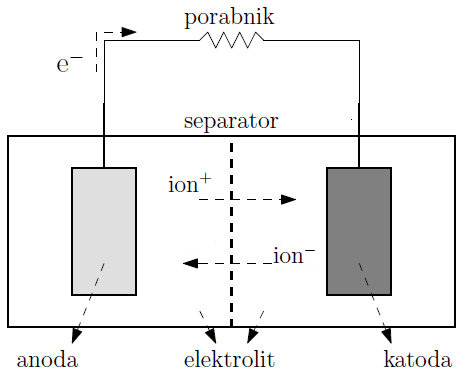
Vezavo več zaporedno vezanih galvanskih členov imenujemo BATERIJA.
Galvanski člen

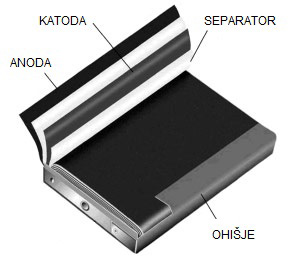
Sestavljen je iz:
- negativne elektrode = ANODE
- pozitivne elektrode = KATODE
- ELEKTROLITA
- PREGRADE oz. separatorja
- PREVODNIKA
ELEKTRODA je običajno kovinska, lahko pa uporabimo tudi grafit.
ANODA je negativna elektroda, ki oddaja elektrone zunanjemu vezju, zato na njej poteka oksidacija.
KATODA je pozitivna elektroda, ki iz zunanjega vezja sprejema elektrone, zato na njej poteka redukcija.
ELEKTROLIT je tekočina, ki obliva elektrodi. Zaradi prisotnosti prostih ionov prevaja električni tok. Večinoma so to vodne raztopine kislin, baz ali soli.
Porozna PREGRADA deli galvanski člen na dva POLČLENA. Uporabimo jo takrat, ko imamo dva različna elektrolita. Omogoča prehod ionov med členoma, preprečuje mešanje elektrolitov in kratek stik med elektrodama.
Če polčlena nista ločena s porozno pregrado, za stik med elektrolitoma uporabimo ELEKTROLITSKI KLJUČ, cevko, napolnjeno z raztopino soli, ki ima na obeh koncih membrano ali preprosto le vato.
PREVODNIK je zunanji kovinski vodnik, navadno žica, s katerim sklenemo elektrodi. Prehajanje elektronov po prevodniku lahko izkoristimo za opravljanje dela.
Električni naboj v raztopinah elektrolitov prenašajo ioni, v kovinah pa elektroni.
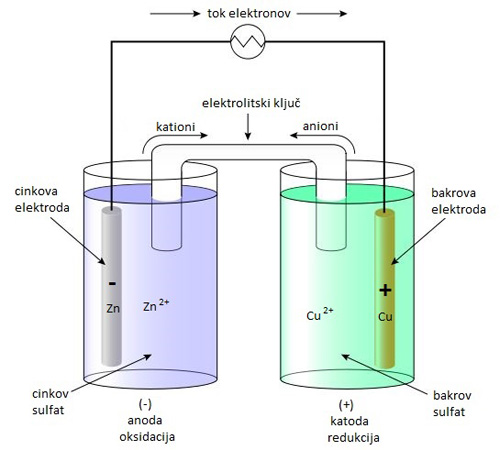
Daniellov galvanski člen
Princip delovanja galvanskega člena najlažje razložimo na primeru Daniellovega člena.
|
Daniellov galvanski člen

|
Oglej si ANIMACIJO delovanja Daniellovega galvanskega člena.
V levem, CINKOVEM POLČLENU, poteka oksidacija cinka.
Anoda je cinkova ploščica, elektrolit pa je vodna raztopina cinkovega sulfata ZnSO4, ki vsebuje Zn2+ ione.
Reakcija oksidacije cinka: Zn(s) → Zn2+(aq) + 2 e-
V desnem, BAKROVEM POLČLENU, poteka redukcija bakra.
Katoda je bakrova ploščica, elektrolit pa vodna raztopina bakrovega sulfata CuSO4, ki vsebuje Cu2+ ione.
Reakcija redukcije bakra: Cu2+(aq) + 2 e- → Cu(s)
Ko vzpostavimo zunanji tokokrog, stečejo elektroni iz cinkove elektrode prek prevodnika na bakrovo elektrodo. Cink se raztaplja, v raztopini se povečuje količina cinkovih Zn2+ ionov.
Bakrovi ioni v raztopini sprejmejo vsak po dva elektrona in se izločijo na katodi. Količina bakrovih Cu2+ ionov v raztopini se zmanjšuje, količina bakra na katodi pa povečuje.
Skupna reakcija: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Električni tokokrog je sklenjen, saj ioni, ki so nosilci električnega naboja, prehajajo skozi elektrolitski ključ, ki uravnoteži naboj med členoma.
Pozitivno nabiti ioni potujejo proti bakrovem polčlenu, negativno nabiti ioni pa proti cinkovem polčlenu.
Reakcija poteka toliko časa, dokler se ne porabi cink ali zmanjka bakrovih ionov v raztopini.
Daniellov člen je primer baterije, ki jo po izrabi ne moremo več napolniti in jo zavržemo.
Pri baterijah, ki jih lahko ponovno polnimo, lahko elektrodi obnovimo s procesom obratne oksidacijsko – redukcijske reakcije → ELEKTROLIZE.
V nasprotni smeri praznjenja pošljemo električni tok iz zunanjega vira, dokler se stanje elektrod in elektrolita ne povrne v začetno.
Oglej si ANIMACIJO ELEKTROLIZE.
Osnovne značilnosti baterij
Vezavo več zaporedno vezanih galvanskih členov imenujemo BATERIJA.
AKUMULATOR je galvanski člen, ki ga po uporabi ne zavržemo in ga lahko ponovno napolnimo.
Polnjenje in praznjenje, kjer akumulator sprejema in oddaja nakopičeno energijo, imenujemo CIKEL. Akumulator zmore več sto ciklov, preden postane neuporaben, odvisno od načina uporabe in vzdrževanja.
ENERGIJA KEMIJSKIH REAKCIJ V BATERIJI:
- Praznjenje baterije je EKSOTERMNA reakcija. Baterija s kemijskimi reakcijami proizvaja električni tok, ki ga lahko izkoristimo za opravljanje dela.
- Polnjenje baterije je ENDOTERMNA reakcija. Elektrodi povežemo z zunanjim izvorom istosmernega električnega toka. Reakcije potečejo v nasprotni smeri, kot pri polnjenju, dokler se elektrodi in elektrolit ne obnovijo. Električna energija se shrani kot kemijska.

Osnovne značilnosti baterij

|

|
ELEKTRIČNA NAPETOST baterije je odvisna od vrste elektrod, elektrolita, njegove koncentracije in števila zaporedno vezanih členov. Enota za merjenje je volt (V), merimo jo z voltmetrom. Lahko jo izmerimo ali izračunamo.
Napetost Daniellovega člena je 1,1 V, napetost alkalne baterije 1,5 V, napetost avtomobilskega akumulatorja pa 12 V.
KAPACITETA nam pove, koliko energije lahko baterija uskladišči. Izrazimo jo z električnim tokom A, ki ga lahko baterija proizvaja določeno število ur. Enota za kapaciteto je amperska ura Ah.
GOSTOTA ENERGIJE predstavlja največjo možno količino električne energije, ki bi jo v idealnem primeru baterija lahko oddala. Odvisna je od kapacitete in napetosti. Izrazimo jo z enoto vatna ura Wh.

Kapaciteto in gostoto energije lahko ponazorimo s steklenico in kozarcem.
Količina vode v steklenici je kapaciteta, hitrost iztekanja vode v kozarec pa je gostota energije.
Oblika in velikost baterij
Pri načrtovanju oblike baterij je potrebno paziti na razmerje med površino in prostornino, da se toplota, ki se sprošča pri reakcijah, čim prej odvede.
Baterije, ki jih uporabljamo za majhne obremenitve, imajo lahko majhno površino na prostornino. Baterije, ki jih uporabljamo pri večjih obremenitvah, pa morajo imeti večjo površino na volumen.
Najpogostejše oblike baterij:
- CILINDRIČNA
- PRIZMATIČNA
- GUMBASTA
- PLOŠČATA

Cilindrična oblika baterij:
- v obliki valja,
- najpogostejša oblika ohišja za uporabo baterij,
- enostavna izdelava,
- vzdržljive in mehansko stabilne,
- v sklopih cilindričnih celic prazen prostor izkoristimo za ohlajanje.
|
|
|
Prizmatična oblika baterij:
- tanke baterije fleksibilnih oblik in velikosti,
- prostor v celici in v sklopih celic je dobro izkoriščen in zato slabo oddaja toploto,
- zaradi pregrevanja lahko nabreknejo in povzročijo samovžig ali eksplozijo,
- mobilni telefoni, tablice, električna vozila.
|
|
Gumbasta oblika baterij:
- v obliki gumba ali kovanca,
- kompaktna oblika,
- zmogljive baterije za majhne naprave,
- slušni aparati, srčni spodbujevalniki, alarmne naprave, avtomobilski ključi.
|
|
Ploščata oblika baterij:
- sestavljene iz treh oz. šestih členov cilindrične ali ploščate oblike,
- kompaktna oblika,
- vzdržljive,
- napetost je 4,5 V ali 9 V .
|
|
|
|
Osnovna delitev baterij
Baterije delimo glede na to, ali jih lahko polnimo.
Primarnih baterij ne polnimo, sekundarne lahko polnimo več stokrat.
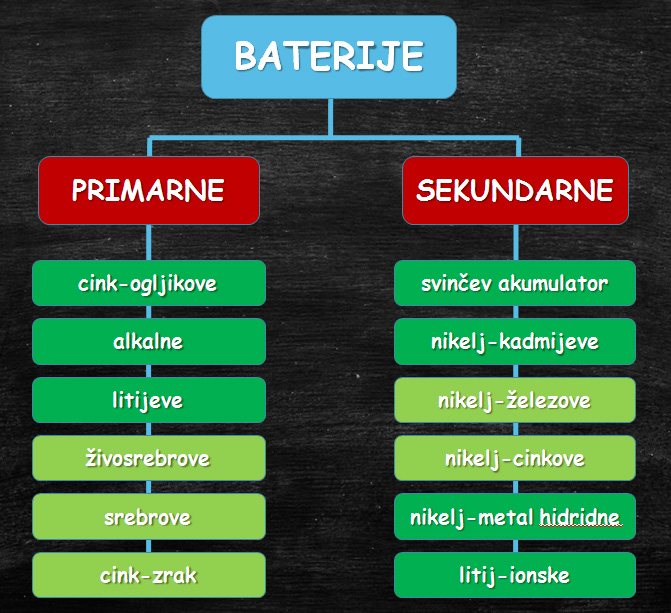
Primarne baterije
- tiste baterije, ki se jih ne da ponovno napolniti,
- po izpraznitvi jih zavržemo,
- enostavne za uporabo, ne potrebujejo vzdrževanja,
- se počasi izpraznijo,
- uporabljamo v napravah z nizko porabo energije: svetilke, ure, daljinci, medicinski pripomočki.

|
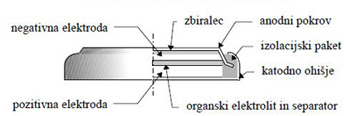
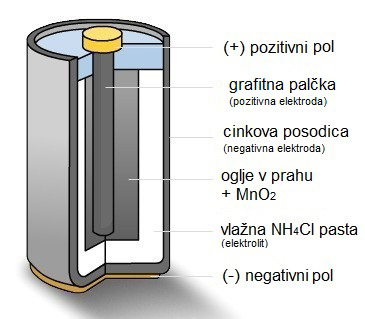
CINK-OGLJIKOVA (ZnC) BATERIJA ali Leclanchéjev suhi člen:
- anoda je cinkova posodica,
- katoda je ogljikova palčka v manganovem dioksidu MnO2, ki mu je za boljšo prevodnost dodano oglje,
- elektrolit je vlažna pasta amonijevega klorida NH4Cl,
- večinoma cilindrične oblike,
- napetost enega člena je 1,5 V, večje napetosti dobimo z zaporedno vezavo več členov (3 V, 4,5 V, 9 V),
- uporabljamo v napravah z nizko porabo energije,
- izpraznjenih baterij ne smemo nikoli puščati v napravah, ki jih napajajo, saj lahko izteče elektrolit ki napravo poškoduje.
Skupna kemijska reakcija:
Zn + 2 MnO2 + NH4Cl + H2O → 2 MnOOH + NH3 + Zn(OH)Cl
|
|
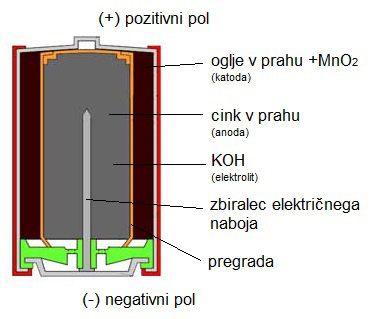
ALKALNA BATERIJA:
- anoda je iz cinka v prahu, katoda je iz manganovega dioksida MnO2, z dodatkom oglja za boljšo prevodnost,
- elektrolit je kalijev hidroksid KOH, ki je baza, zato te baterije imenujemo alkalne,
- cilindrične in gumbaste oblike,
- napetost ene celice je 1,5 V,
- imajo dolgo življenjsko dobo,
- nekatere lahko tudi ponovno polnimo v specializiranih polnilcih, vendar le nekaj 10-krat.
Skupna kemijska reakcija:
2 MnO2 + Zn + 2 H2O → 2 MnOOH + Zn(OH)2
|
|
LITIJEVA BATERIJA:
- anoda je iz litija
- katode so različne, največkrat manganov dioksid MnO2,
- elektrolit je nevodna raztopina litijevih soli, saj litij burno reagira z vodo,
- gumbaste, cilindrične in prizmatske oblike,
- napetost do 4 V,
- uporabljamo v medicinskih in varnostnih napravah, vojski, ključih, urah,
- ne smemo jih polniti, saj lahko eksplodirajo.
Skupna kemijska reakcija z najpogostejšo katodo:
Li + MnO2 → LiMnO2
|
|
|
SEKUNDARNE BATERIJE
- tiste baterije, ki jih po izpraznitvi ponovno napolnimo,
- imenujemo jih tudi AKUMULATORJI,
- se hitreje izpraznijo,
- uporabljamo v napravah z visoko porabo energije: avtomobili, mobilni telefoni, prenosni računalniki, električno orodje,
- shranjevanje električne energije za čas, ko ta ni dostopna.
|
|
|
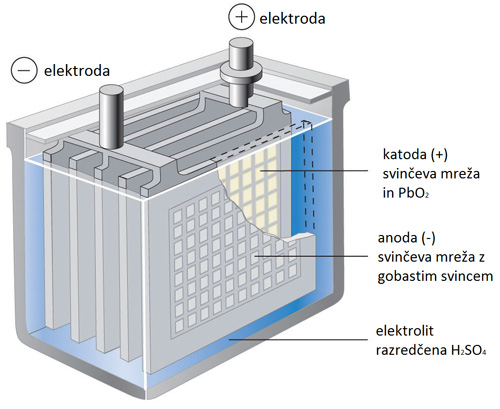
SVINČEV AKUMULATOR:
- svinčeva anoda, katoda je svinčev dioksid PbO2,
- elektrolit je žveplova kislina H2SO4,
- napetost enega člena je približno 2 V, v avtomobilskem akumulatorju je povezanih šest členov v 12 V baterijo,
- uporabljamo v avtomobilih, viličarjih, invalidskih vozičkih, zasilni razsvetljavi, hibridnih vozilih, itd.
Skupna kemijska reakcija:
Pb + PbO2 + 2 H2SO4 ←→ 2 PbSO4 + 2H2O
|
|
Akumulator je vir napetosti in med uporabo deluje enako kot galvanski člen. Po sklenjenem električnem krogu, v katerega je vključen porabnik, poganja električni tok. Ob tem se prazni, oddaja električno delo, skupna notranja energija pa se mu zmanjšuje.
Ob polnjenju ga priključimo na zunanji vir napetosti (alternator, ali posebej prilagojen polnilnik za električno omrežje).
Pozitivno elektrodo zvežemo z negativnim priključkom polnilnika, negativno elektrodo pa s pozitivnim priključkom polnilnika. Zunanji polnilnik pri polnjenju poganja v akumulatorju tok in s tem kemijske reakcije v nasprotni smeri.
Akumulatorju tako dovajamo električno delo, skupna notranja energija se povečuje. Napolnjen akumulator lahko zopet uporabimo kot vir napetosti.
NIKELJ-KADMIJEVA (NiCd) BATERIJA:
- anoda je kadmij, katoda nikelj, elektrolit kalijev hidroksid KOH,
- zaradi strupenosti kadmija je v Evropi prepovedana proizvodnja,
- napetost enega člena je 1,25 V,
- napolnimo jih lahko več kot 1000-krat, uporabljamo več let,
- izrazit spominski efekt,
- zaganjalniki za letalske motorje, prenosno električno orodje, medicinske naprave, zasilne zavore, itd.
Skupna kemijska reakcija:
2 NiOOH + Cd + 2 H2O ←→ 2 Ni(OH)2 + Cd(OH)2
| 
|
SPOMINSKI EFEKT NiCd in NiMH baterij
Baterije, ki so podvržene cikličnemu praznjenju in polnjenju (npr. v satelitih, ki krožijo po stalnih tirnicah), si zapomnijo koliko energije so v prejšnjih ciklih prejele ali oddale in kasneje ne oddajo oz. sprejmejo več energije, četudi bi teoretično morale imeti višjo kapaciteto.
V novejših NiCd baterijah sicer ni cikličnega spominskega efekta, so pa baterije podvržene tvorbi kristalov, ki ravno tako znižujejo kapaciteto.
Spominski efekt preprečimo tako, da praznjenje v nobenem ciklu ni enako, baterijo pa enkrat mesečno pred polnjenjem izpraznimo in jo nato napolnemo.
Spominskemu efektu so podvržene tudi NiMH baterije, vendar v manjši meri kot NiCd.
Litij-ionske baterije spominskega efekta nimajo.

O nikelj-kadmijevi bateriji in spominskem efektu si lahko več prebereš na Wikipediji.
NIKELJ-METAL HIDRIDNA (NiMH) BATERIJA:
- podobne NiCd baterijam, le da je namesto kadmija uporabljena posebna zlitina kovinskega hidrida,
- napetost enega člena je 1,25 V,
- s posebnim polnilcem jih lahko napolnimo 300- do 600-krat ,
- spominski efekt je manj izražen kot pri NiCd baterijah,
- uporabljamo v hibridnih vozilih, medicinskih napravah,
- lahko jih recikliramo.
Poenostavljena skupna kemijska reakcija, kjer z M označimo kovino:
MH + NiOOH ←→ M + Ni(OH)2
|
|
|
LITIJ-IONSKE BATERIJE:
- različni materiali za anode, katode in elektrolit,
- več oblik litij-ionskih baterij, npr. litij kobaltat, litij mangan oksid, litij-polimerne, litij železo fosfatne, litij žveplove, itd.,
- napolnimo jih lahko več kot 1000-krat,
- prizmatične, cilindrične in gumbaste oblike,
- napetost celice je od 2,5 do 4,2 V, odvisno od uporabljenih katodnih materialov,
- danes najdemo v večini prenosnih elektronskih naprav.
|
|
Litij-ionske baterije nimajo izraženega spominskega efekta, zato jih lahko polnimo delno izpraznjene.
Priporoča se, da napolnjenost baterije ne pade pod 30 %, pri polnjenju pa se izogibajmo napolnjenosti nad 95 %.
Izjemoma se priporoča popolno praznjenje in nato polnjenje do 100 % zaradi kalibracije baterije (težave zaradi elektronike in ne baterije), vendar ne več kot enkrat mesečno.
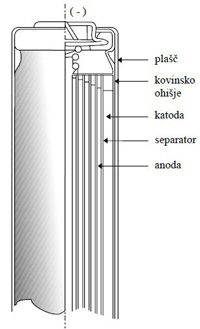
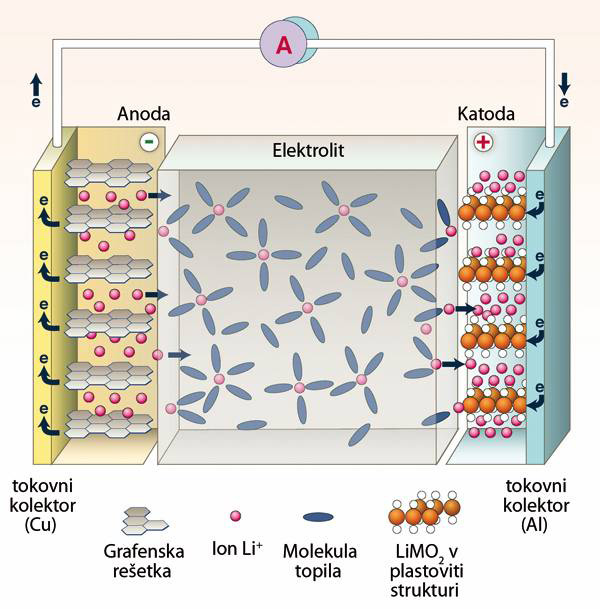
Delovanje litij-ionskih baterij
Delovanje litij-ionskih baterij je nekoliko drugačno, saj litijev kation sodeluje v kemijskih reakcijah na obeh elektrodah.
|
Pri praznjenju v grafitni strukturi vgrajeni litijevi ioni oddajo elektron, se od tam umaknejo in se vgradijo v oksidno strukturo, kjer sprejmejo elektron.
Pri polnjenju litijevi ioni vgrajeni v oksidni strukturi oddajo elektron, se od tam umaknejo in se vgradijo nazaj v grafitno strukturo, kjer elektron sprejmejo.
Elektrodi loči brezvodni elektrolit, ki omogoča prenos litijevih ionov med njima.
Animacija delovanja litij-ionske baterije
Kako podaljšati življenjsko dobo litij-ionskim baterijam?
- izklopite napravo na baterije, kadar je ne uporabljate,
- uporabljajte originalne polnilce,
- odstranite baterijo iz prenosnega računalnika, ki je ves čas na omrežni napetosti,
- izogibajte se večkratni izpraznjenosti baterije,
- baterije ne polnite “čez noč”,
- uporabljajte večkratne krajše intervale polnjenja,
- baterijo, ki jo ne uporabljate, hranite 40–60 odstotno polnjene v hladnem in suhem prostoru,
- izogibajte se temperaturam nad 30 °C - izpostavljanju naprave direktnemu soncu, puščanju telefona v razgretem avtomobilu ali na okenski polici, nošenje telefona v žepu hlač, zapiranju izhoda ventilatorja prenosnika, s telefona odstranite pokrovčke,
- ne “oživljajte” prazne baterije na radiatorju.
Varna uporaba baterij

|

|

|

|
- baterije moramo uporabljati v skladu z navodili,
- iztrošene zamenjujemo le z baterijami iste vrste oz. v skladu z navodili proizvajalca,
- pazimo na pravilno vstavitev baterije v napravo,
- ne smemo jih razstavljati, polniti izven sistema, mehansko poškodovati, izpostavljati ognju, soncu, vodi,
- odstranimo jih iz naprave, ki jo dlje časa ne bomo uporabljali,
- ne polnite baterij, na katerih ni označeno, da se lahko ponovno polnijo.
IZTEKANJE:
- baterije lahko puščajo toksične snovi: svinec, živo srebro, kadmij, kisli ali bazični elektrolit,
- iztekel elektrolit lahko poškoduje elektronsko napravo,
- pri rokovanju s poškodovano ali izteklo baterijo uporabite zaščitne rokavice, saj lahko iztekla snov povzroči poškodbe kože, oči in sluznic,
- ne mešajte starih baterij z novimi, saj se lahko poškodujejo.
EKSPLOZIJO ali POŽAR lahko povzročite:
- z izpostavljanjem ognju ali direktnemu soncu,
- luknjanjem ali drugimi mehanskimi poškodbami,
- pri temperaturah višjih od 60 °C,
- s polnjenjem primarnih baterij,
- s prenapolnjenjem baterije,
- baterija prenosnika lahko eksplodira večkrat, saj je sestavljena iz več celic.
KRATEK STIK nastane zaradi neposredne povezave med pozitivnim in negativnim polom baterije, brez priključenega vmesnega porabnika. Visok električni tok, ki steče skozi baterijo, povzroči lokalno pregretost, razlitje vsebine, vžig ali celo eksplozijo.
ZAUŽITJE Nekatere baterije so lahko ob zaužitju smrtno nevarne, toksične pa so tudi spojine, ki jih vsebujejo.
Baterije je potrebno hraniti izven dosega otrok.
Ob zaužitju je potreben takojšen obisk zdravnika.

|
Ekologija
|

|
- Baterije ne sodijo v zabojnike za mešane komunalne odpadke, temveč med nevarne odpadke,
- ob nepravilnem odlaganju lahko onesnažijo podtalnico in zemljo s težkimi kovinami (Cd, Hg, Pb), kisli oz. alkalni elektroliti lahko povzročijo opekline in poškodbe oči, kože, sluznic,
- neizpraznjene lahko zaradi kratkega stila povzročijo požar ali eksplozijo,
- doma jih hranimo ločeno od drugih odpadkov,
- odlaganje v naravi ali sežiganje je strogo prepovedano,
- nepravilno odložene baterije iz gospodinjstev prispevajo 88 % živega srebra in 50 % kadmija v skupnih komunalnih odpadkih,
- za izdelavo ene baterije potrebujemo 50-krat več energije, kot jo sama baterija proizvede,
- izpraznjene baterije lahko brezplačno oddamo pri prodajalcih baterij v posebne zabojnike, ali jih odnesemo izvajalcu javne službe v zbirni center,
- z recikliranjem prihranimo veliko energije in ohranjamo naravne vire,
- v Sloveniji svinčeve akumulatorje reciklira podjetje MPI iz Črne na Koroškem.

|
Razvoj novih baterij:

|

|
- izboljšave trenutnih litij-ionskih baterij,
- raziskave novih sistemov z bolj dostopnimi materiali, npr. litij-žveplove baterije,
- raziskave cenejših materialov, npr. natrijeve, magnezij-žveplove, cink-zrak, redoks pretočne baterije, gorivne celice,
- raziskave z organskimi materiali, npr. sladkor iz koruze, jabolčna kislina, virusi, bakterije,
- napredek v nanotehnologiji, uporaba grafena.
V Sloveniji imamo na Kemijskem inštitutu zelo uspešno skupino raziskovalcev, ki jih vodi dr. Robert Dominko. V okviru projekta Eurolis, ki se uspešno nadaljuje v projekt Helis, se ukvarjajo s temeljnimi raziskavami litij-žveplovih akumulatorjev, v sodelovanju s Hondo pa razvijajo magnezij-žveplove baterije.

|
Litij-žveplovi akumulatorji so zanimivi zaradi žvepla, ki je lažje, dostopnejše in posledično cenejše. Z žveplom se izognemo tudi niklju in kobaltu.
Takšne baterije so zelo zanimive ne le za avtomobilsko industrijo, temveč tudi za vesoljsko (dviganje satelitov v orbito) ter vojsko, saj so veliko lažje od že obstoječih.
Uporaba baterij v prihodnosti

|

|

|
ELEKTRIČNA VOZILA predstavljajo velik del razvoja baterij. Zaradi zmanjševanja fosilnih zalog goriva in vse večjega problema izpusta CO2 ter ostalih izpušnih plinov, postajajo čedalje bolj pomemben del predvsem mest, saj neposredno ne onesnažujejo okolja z izpusti in tako pripomorejo k čistejšemu zraku.
HIŠNI HRANILNIKI ENERGIJE so velike baterije, ki napajajo celotna gospodinjstva.
Polnimo jih takrat, ko imamo poceni vir električne energije – ponoči iz električnega omrežja, ali podnevi s presežki lastne sončne elektrarne.
Uporabljamo jih v času višjih cen energije oz. ponoči. Omogočajo nam neodvisnost od električnega omrežja oz. rezervno električno energijo ob izpadih omrežja (žled).
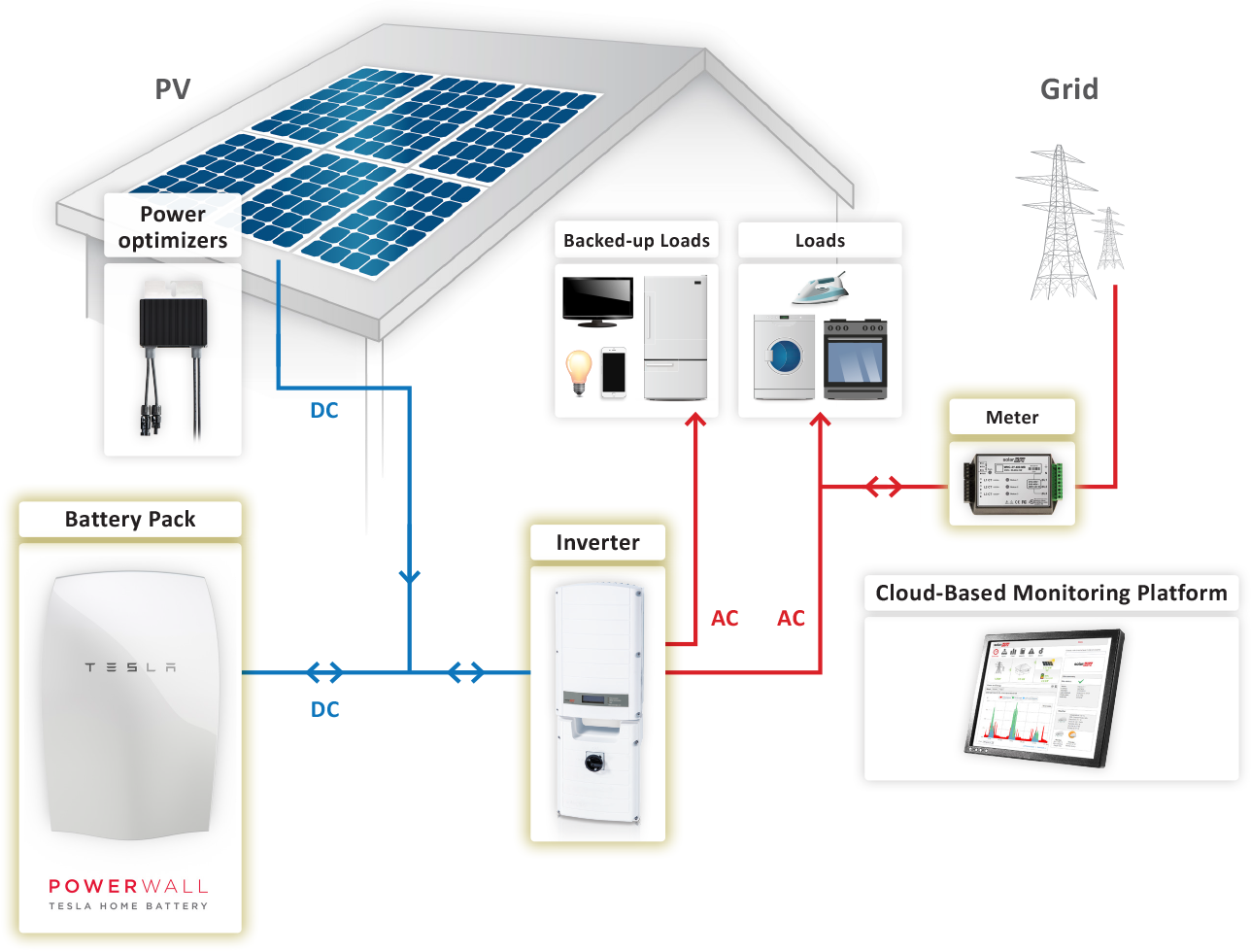
|
PAMETNA OMREŽJA so elektroenergetska omrežja, ki z uporabo informacijsko-komunikacijskih tehnologij, s primernim odzivom ob večji proizvodnji električne energije iz obnovljivih virov zmanjšajo porabo fosilnih goriv, presežke pa shranijo v baterijah.
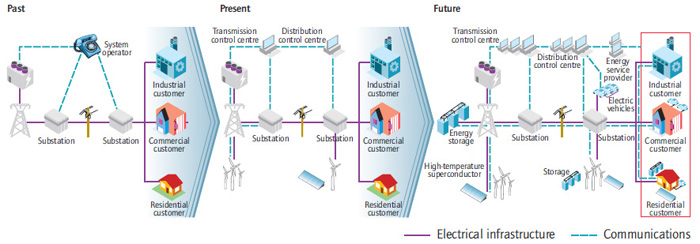
|
Ob večjih vetrnih ali sončnih elektrarnah v tujini gradijo VELIKE BATERIJE, ki shranjujejo presežno električno energijo v času delovanja in jo oddajajo v omrežje, ko elektrarne ne delujejo (brezvetrje, noč).
Velike baterije štejejo več deset ali sto tisoč členov, večinoma litij-ionskih baterij.

|
VIRI SLIK
Kopač, D. (2009). Baterije. Seminarska naloga, Ljubljana: Univerza v Ljubljani, Fakulteta za matematiko in fiziko, Oddelek za fiziko. Dostopno na spletu, citirano 31.8. 2016.
Štirn, S. (2016). Baterije – e-učna enota. Diplomsko delo, Ljubljana: Univerza v Ljubljani, Pedagoška fakulteta.
Voršič, J. in Orgulan, A. (1996). Pretvarjanje v električno energijo. Maribor: Fakulteta za elektrotehniko, računalništvo in informatiko. Dostopno na spletu, citirano 31. 8. 2016.
Spletni viri slik so zbrani s povezavami v Pinterest albumu.
- Kaj je skupnega napravam na sliki?
- Baterije nekoč in danes
- Bagdadska baterija
- Luigi Galvani (1737-1798)
- Alessandro Volta (1745-1827)
- John Frederic Daniell (1790-1845)
- Gaston Planté (1834-1889)
- Georges Leclanché (1839-1882)
- Carl Gassner (1839-1882)
- Waldemar Junger (1869-1924)
- Thomas Alva Edison (1847-1931)
- Lewis Frederick Urry (1927-2004)
- Stanford Robert Ovshinsky (1922-2012)
- Razvoj litijevih baterij
- Galvanski člen
- Galvanski člen
- Daniellov galvanski člen
- Daniellov galvanski člen
- Osnovne značilnosti baterij
- Osnovne značilnosti baterij
- Oblika in velikost baterij
- Cilindrična oblika baterij:
- Prizmatična oblika baterij:
- Gumbasta oblika baterij:
- Ploščata oblika baterij:
- Osnovna delitev baterij
- Primarne baterije
- CINK-OGLJIKOVA (ZnC) BATERIJA ali Leclanchéjev suhi člen:
- ALKALNA BATERIJA:
- LITIJEVA BATERIJA:
- SEKUNDARNE BATERIJE
- SVINČEV AKUMULATOR:
- NIKELJ-KADMIJEVA (NiCd) BATERIJA:
- NIKELJ-METAL HIDRIDNA (NiMH) BATERIJA:
- LITIJ-IONSKE BATERIJE:
- Delovanje litij-ionskih baterij
- Animacija delovanja litij-ionske baterije
- Kako podaljšati življenjsko dobo litij-ionskim baterijam?
- Varna uporaba baterij
- Ekologija
- Razvoj novih baterij:
- Uporaba baterij v prihodnosti
- VIRI SLIK